Amonyak (NH3) Asit mi Baz mı

chemistryhocam
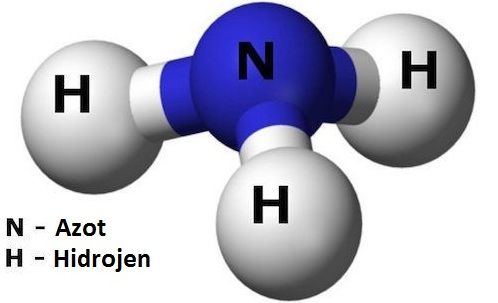
Amonyak, bir tane azot (N) atomu ile 3 tane hidrojen (H) atomunun bir araya gelmesi ile oluşan keskin kokulu, renksiz bir gazdır. Hidroksil iyonu (OH-) içermedi
Amonyak, bir tane azot (N) atomu ile 3 tane hidrojen (H) atomunun bir araya gelmesi ile oluşan keskin kokulu, renksiz bir gazdır. Hidroksil iyonu (OH-) içermediği halde sulu çözeltileri zayıf baz özelliği gösterir. Baygınlık geçiren kişileri ayıltmak için bir miktar amonyak koklatılabilir ama fazla miktarda solunması halinde zehirler.
Arrhenius Asit-Baz Tanımı
Svante Arrhenius’a (1859-1927) göre asitler, suda çözündüklerinde ortama hidrojen iyonu (H+) verebilen veya arttırabilen bileşikler iken; bazlar ise, suda çözündüklerinde ortama hidroksil (OH-) iyonu verebilen veya arttırabilen bileşiklerdir ( Asitler ve Bazlar
). Arrhenius’e göre asitler HX, bazlar ise MOH genel formülüne sahiptir. Arrhenius’un bu tanımına göre HCl, (H+) iyonu içerdiği için bir asit iken; NaOH, (OH-) iyonu içerdiği için bir bazdır.
Ancak, Arrhenius’un asit-baz tanımının kendi içerisinde bazı çelişkili yanları bulunmakta olup örneğin zayıf bir baz olan ve 1 tane azot (N) ile 3 hidrojen (H) atomundan oluşan amonyağın (NH3'ün) bazlığını açıklayamamaktadır. Çünkü Arrhenius, yapısında hidroksil (OH) bulunmadığı halde amonyağın sulu çözeltisinin neden asit yerine (H bulunduğu için) baz özelliği gösterdiğini veya bazik olduğunu açıklayamıyordu.
Brönsted-Lowry Asit-Baz Tanımı
1923 yılında birbirlerinden bağımsız olarak Danimarkalı bilim adamı Johannes Nicolaus Brønsted (1879-1947) ve İngiliz bilim adamı Thomas Martin Lowry (1874-1936), asidleri proton (H+ iyonu) veren ve bazları ise proton (H+ iyonu) alan bileşikler olarak tanımladı.
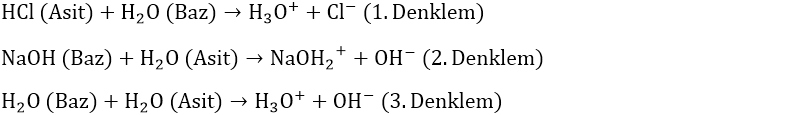
Yukarıdaki 1. denklemde HCl, 1 tane proton (H+ iyonu) vererek (Cl-) iyonuna dönüştüğü için bir asit iken; H2O, 1 tane proton (H+ iyonu) alarak (H3O+) iyonuna dönüştüğü için bir bazdır.
2. Denklemde NaOH, 1 tane proton (H+ iyonu) alarak (NaOH2+) iyonuna dönüştüğü için bir baz iken; H2O, 1 tane proton (H+ iyonu) vererek (OH-) iyonuna dönüştüğü için bir asittir.
3. Denklemde 1 tane proton (H+ iyonu) alarak (H3O+) iyonuna dönüşen ilk H2O molekülü bir baz iken; 1 tane proton (H+ iyonu) vererek (OH-) iyonuna dönüşen ikinci H2O molekülü ise bir asittir.
Saf Suyun Asitliği-Bazlığı (Saf Suyun İyonlarına Ayrışması)
Saf su (H2O) çok az da olsa iyonlarına ayrışabildiği için zayıf da olsa elektriği iletir. Eşit miktarda (H+) (Doğrusu H3O+) ve (OH-) iyonlarına ayrıştığı için ne asit ne de baz olup nötr bir bileşiktir. Bu nedenle renksiz, kokusuz ve tatsızdır. Ancak piyasada damacana veya şişe şeklinde satılan suların, pH değeri 7'den biraz büyük (7,10 ile 8,00 arası) olduğu için hafif bazik olup tatları da biraz acımsıdır. Arrhenius ile Brönsted ve Lowry'ye göre saf su aşağıdaki şekildeki gibi iyonlarına ayrışır.
Amonyağın Baz Oluşu (Amonyağın Bazlığı)
Amonyak (NH3) Asit mi? bazı mı? sorusunu, amanyok su ile tepkimeye girdiğinde bir asit gibi mi? yoksa bir baz gibi mi? davranır diye sormak daha doğrudur. Brönsted-Lowry Asit-Baz Tanımına göre Amonyak (NH3), su ile reaksiyona girdiğinde bir baz gibi davranır.
Amonyak, hidroksil (OH-) iyonu içermeyen baz sınıfının tipik bir üyesidir. Su ile reaksiyona girdiğinde amonyum (NH4+) ve hidroksil (OH-) iyonu üretir. Amonyağın su ile tepkimesinde amonyak moleküllerinin ancak %1'lik bir kısmı tepkimeye girer ve bu yüzden zayıf bir bazdır. Geri kalan %99'luk kısmı tepkimeye girmediği için tepkime geri döndürülebilir bir tepkimedir.
Yukarıdaki denklemde NH3, sudan (H2O'dan) 1 tane proton (H+ iyonu) alarak amonyum (NH4+) iyonuna dönüştüğü için bir baz iken; H2O, Amonyağa (NH3'e) 1 tane proton (H+ iyonu) vererek (OH-) iyonuna dönüştüğü için bir asittir.
Share Your Expertise, Earn Rewards!
Found this insightful? Imagine your knowledge generating income. Contribute your articles to bylge.com and connect with readers while unlocking your earning potential.